Arriva il via libera per il vaccino da parte del Ceo dell’azienda statunitense: la terza settimana di novembre
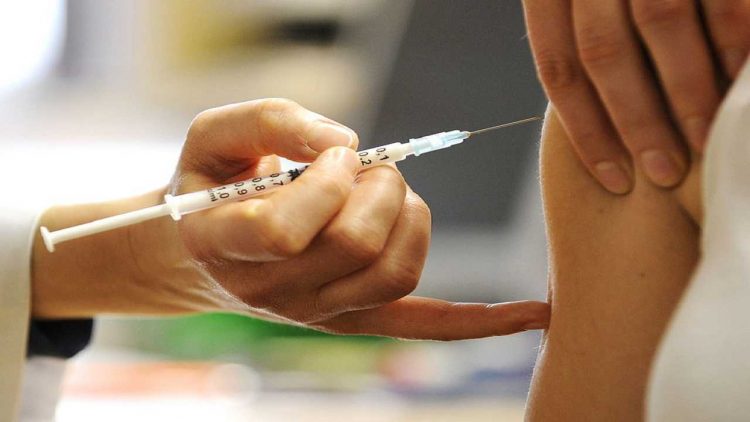
La casa farmaceutica Pfizer prevede di chiedere l’autorizzazione per il suo vaccino contro il coronavirus all’agenzia americana Fda nella terza settimana di novembre. Lo rende noto l’amministratore delegato di Pfizer, Albert Bourla sul sito internet della società con una lettera, poi rilanciata dal professor Roberto Burioni su Twitter. “Ci sono tre aree in cui, come per tutti i vaccini, dobbiamo dimostrare di avere successo per ottenere prima l’approvazione per l’uso pubblico — scrive Bourla — Innanzitutto il vaccino deve essere efficace, il che significa che può aiutare a prevenire il Covid-19 nella maggior parte dei pazienti vaccinati. In secondo luogo bisogna dimostrare che il vaccino sia sicuro, con dati affidabili generati da migliaia di pazienti. Infine, dobbiamo dimostrare che il vaccino può essere costantemente prodotto secondo i più elevati standard di qualità”.
TI POTREBBE INTERESSARE ANCHE>>>Vite al Limite. Brandon Scott, 325 kg. Totalmente un’altra persona
Vaccino, il verdetto entro la fine di ottobre
“Potremmo sapere se il nostro vaccino è efficace – spiega il Ceo nella sua lettera – entro la fine di ottobre e per farlo dobbiamo accumulare un certo numero di casi Covid-19 nel nostro studio per confrontare l’efficacia del vaccino negli individui vaccinati con quelli che hanno ricevuto un placebo”. A quel punto sarà un comitato di scienziati indipendenti a esaminare il vaccino della casa farmaceutica statunitense e a stabilire la sua efficacia nella cura al virus.
TI POTREBBE INTERESSARE ANCHE>>>>Bianca Atzei | bellissima anche con gli occhi tristi | FOTO
Nuova data: terza settimana di novembre
Nel caso in cui il responso degli esperti sia positivo, Pfizer spiega che per l’autorizzazione all’uso di emergenza negli Stati Uniti di un potenziale vaccino la U.S. Food and drug administration richiede che le società forniscano due mesi di dati di sicurezza su metà dei partecipanti alla sperimentazione dopo la dose finale della cura. Un traguardo che l’azienda stima di raggiungere nella terza settimana di novembre. “La sicurezza è e rimarrà la nostra priorità numero uno e continueremo a monitorare e riportare i dati sulla sicurezza per tutti i partecipanti allo studio per due anni”. Dichiara Albert Bourla.
Abbiamo una data. Albert Bourla, amministratore delegato di Pfizer scrive che se tutto andrà bene presenterà una richiesta per un’autorizzazione di emergenza del vaccino contro COVID-19 nella terza settimana di novembre 2020. Forza! https://t.co/uFyN0jLzLz pic.twitter.com/hopP1tOB4g
— Roberto Burioni (@RobertoBurioni) October 16, 2020
“Pfizer richiederà l’uso dell’autorizzazione negli Usa – conclude l’amministratore delegato di Pfizer – subito dopo il raggiungimento della pietra miliare della sicurezza nella terza settimana di novembre”.
Se vuoi essere sempre informato in tempo reale, seguici anche su sulle nostre pagine Facebook, Instagram e Twitter